Nature Communications 12, 756 (2021)
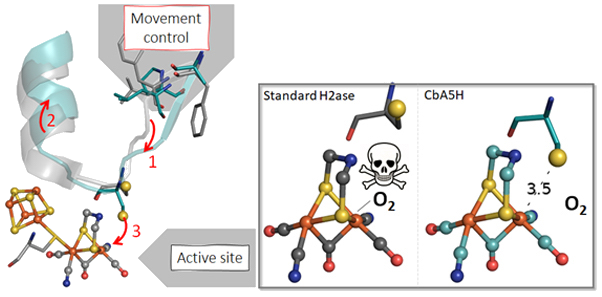
On considère habituellement que l’activité catalytique de métalloenzymes comme les hydrogénases, utilisées pour la production de dihydrogène, est déterminée par les premiers voisins des ions métalliques de leur site actif. Des scientifiques du Laboratoire de bioénergétique et ingénierie des protéines (CNRS, Aix-Marseille Université) et des Universités de Bochum (Allemagne) et de Turin (Italie) viennent de montrer dans la revue Nature Communications comment des acides aminés bien plus éloignés du métal conditionnent également la réactivité de l’hydrogénase de la bactérie Clostridium beijerinckii.
- Lire la suite sur le site du CNRS: web
- Référence: Martin Winkler, Jifu Duan, Andreas Rutz, Christina Felbek, Lisa Scholtysek, Oliver Lampret, Jan Jaenecke, Ulf Peter Apfel, Gianfranco Gilardi, Francesca Valetti, Vincent Fourmond, Eckhard Hofmann, Christophe Léger & Thomas Happe, A safety cap protects hydrogenase from oxygen attack, Nature Communications 12, Article number: 756 (2021), doi: 10.1038/41467-020-20861-2
Plus d'actualités / More news
