Métabolisme de l’hydrogène
Hydrogen metabolismResearch
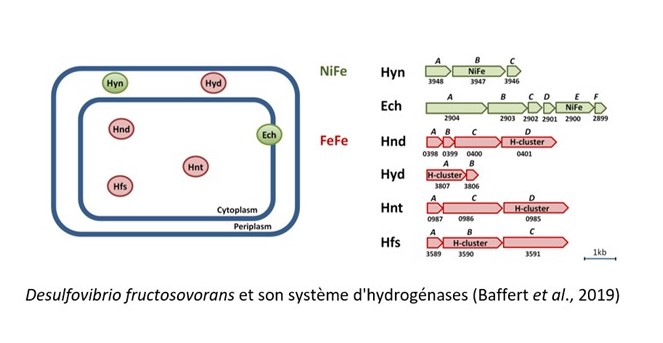
Actuellement, nos recherches se focalisent sur l’étude d’une hydrogénase à [FeFe] de cet organisme, Hnd, qui réalise la bifurcation des électrons. Les enzymes qui bifurquent les électrons réalisent le couplage énergétique d’une réaction rédox exergonique avec une réaction rédox endergonique. La bifurcation des électrons émerge actuellement comme principe fondamental des mécanismes de conservation d’énergie du vivant. De nombreuses flavoenzymes pourraient réaliser la bifurcation des électrons mais un nombre très restreint de modèles enzymatiques fait l’objet de recherches.
Parmi ces enzymes, une nouvelle classe d’hydrogénases à [FeFe] multimériques a été mise en évidence chez les bactéries anaérobies. Ces enzymes présentent la particularité d’utiliser deux accepteurs/donneurs d’électrons simultanément. Il a en effet été montré que ces hydrogénases couplent la réduction des protons à l’oxydation endergonique du NADH et à l’oxydation exergonique concomittante d’une ferredoxine réduite (et/ou la réaction inverse). Nous étudions cette enzyme depuis son fonctionnement moléculaire jusqu’à son rôle physiologique dans la bactérie.
Nos recherches ont également pour objectifs de lever les verrous scientifiques à l’utilisation des hydrogenases dans des procédés biotechnologiques et notamment de comprendre les bases moléculaires de l’inactivation des hydrogénases par l’O2 qui est une des limitations principales actuelles. En effet, le dihydrogène est considéré comme un carburant « propre » du futur, en alternative aux carburants fossiles à condition qu’il ne soit plus produit à base d’énergie fossile. Dans ce contexte, la conversion de l’énergie solaire en H2 constitue une stratégie attrayante pour la bioproduction de ce combustible. Les solides compétences de l’équipe en génétique, biologie moléculaire et biochimie des hydrogénases nous ont conduit à prendre part à plusieurs projets financés par l’ANR (Engineering-H2 Cyano, 2009-2013; Algo-H2, 2011-2015; Cyanhy, 2013-2017) sur l’ingénierie d’organismes photosynthétiques (cyanobactéries ou microalgue verte Chlamydomonas) en vue d’une photo-bioproduction d’H2.
Parallèlement à l’étude des hydrogénases, une deuxième thématique de recherche concernant les oxydases terminales et la respiration aérobie bactérienne est développée au sein de l’équipe. Actuellement, nous nous intéressons en particuliers à l’oxydase de type bd (de Desulfovibrio fructosovorans et d’Escherichia coli). Par des approches de biochimie, biophysique et physico-chimie, en collaboration avec l’équipe « Biophysique des metalloprotéines » (mettre un lien vers l’équipe) du laboratoire, nous réalisons une étude moléculaire et fonctionnelle de cette enzyme.
