Bioélectrochimie, biointerfaces et biotechnologies
Bioelectrochemistry, biointerfaces and biotechnologiesResearch
Our models:
Our research directions:
Molecular Basis for Bioelectrocatalysis
Electrode Nanostructuration
Development of Coupled Methods
Enzymatic Fuel Cells
Molecular Basis for Bioelectrocatalysis
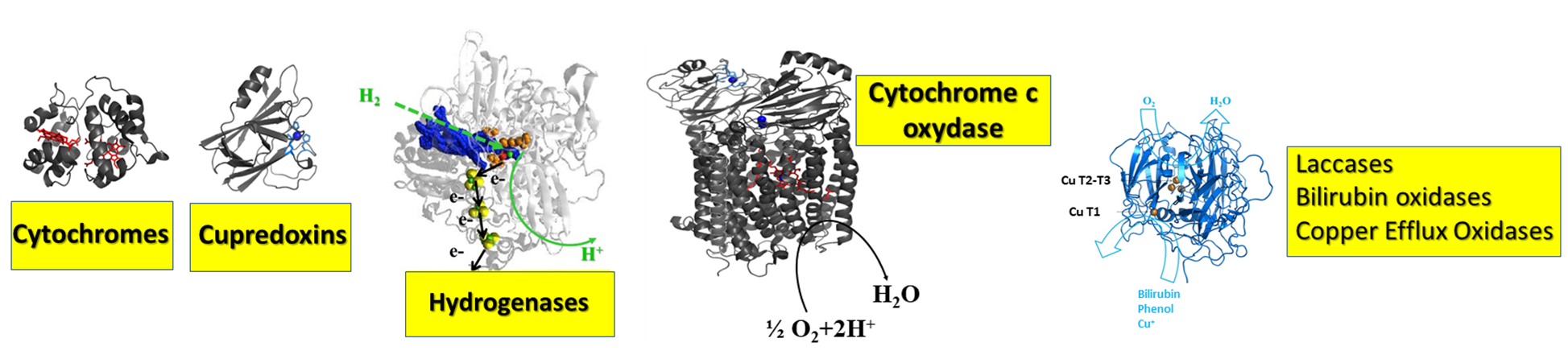
🇬🇧 Electron transfers in energy metabolic chains occur through transitory protein complexes. Hydrophobic and electrostatic interactions are the main forces involved in the physiological recognition, allowing a short distance between two interacting partners. In many redox enzymes, intramolecular and intermolecular electron transfers are facilitated by the existence of redox cofactors, which form electrical conducts, in addition to the active site, the last or first cofactors being exposed the surface. In the particular cases we are working on, these co-factors are i) FeS clusters in addition to NiFe active site for the hydrogenase, and ii) Cu T1 in addition to the TNC in multicopper oxidases (MCOs, BOD, Lac or CueO).

Our main objective here is to mimic physiological electron transfer pathways by replacing the partner by the electrode, which will be chemically functionalized to allow enzyme orientation for a favoured electron transfer. We consider both planar and nanostructured electrodes (deposited nanoparticules in particular). In addition to this direct electron transfer process, we also quantify electron transfers mediated by redox mediators mainly diffusing in solution. The ratio between these two types of electron transfer processes provides a rough estimation of the percentage of enzymes that can be directly wired. By coupling electrochemisty to molecular modelling and spectroscopies, we have proposed models for hydrogenase and multi copper oxidase orientation on electrodes. We have especially highlighted the role of electrostatic interactions in such processes.We propose that the examination of charges in the environment of the last/first cofactor (FeS distal cluster in the case of the hydrogenase and Cu T1 for BOD and Lac), as well as the direction of the dipole moment are key factors for the control of interfacial electron transfer.
In the particular case of CueO-like enzymes, electrode functionalization has allowed us to demonstrate the of a methionine domain covering the Cu T1. This domain modifies the electron transfer pathway compared to other MCOs, but allows copper binding and Cu+ detoxification.

🇫🇷 Au sein des chaines métaboliques énergétiques, les transferts d’électrons se font via la formation de complexes protéiques transitoires. La reconnaissance physiologique préalable est contrôlée par des interactions hydrophobes et électrostatiques, qui maintiennent une distance minimale entre partenaires favorable à un transfert d’électrons intermoléculaire. Dans de nombreuses enzymes redox, les transferts d’électron intra- et intermoléculaires sont facilités par l’existence de cofacteurs redox qui assurent la connexion électrique du site actif depuis/vers la surface de la protéine. Dans le cas des enzymes qui nous intéressent plus particulièrement, ces cofacteurs sont : i) pour l’hydrogénase, des clusters FeS distants de moins de 1 nm et qui assurent le transfert des électrons depuis le site actif NiFe lors de l’oxydation de H2; ii) pour les oxydases multi-cuivre (MCOs, laccases, bilirubine oxydases ou CueOs) un Cu de type T1 où se lie le substrat physiologique et qui permet de relier électriquement le centre 3 Cu où a lieu la réduction de O2.
L’objectif principal de notre recherche est de mimer les chemins de transfert physiologique des électrons en remplaçant le partenaire par une surface conductrice, l’électrode, qu’il s’agit de modifier chimiquement pour positionner l’enzyme dans une orientation favorable au transfert d’électrons. Nous considérons à la fois des électrodes planes et des électrodes nanostructurées (dépôt de nanoparticules en particulier). En plus de l’analyse de ce transfert direct des électrons, nous quantifions les courants de catalyse médiés par des molécules redox diffusantes en solution. Le ratio de ces deux courants catalytiques nous permet d’accéder au pourcentage d’enzymes en connexion directe. De plus, en couplant l’analyse électrochimique à de la modélisation et à diverses spectroscopies, il nous est possible de proposer des modèles d’orientation des enzymes sur l’interface électrochimique. Nous avons en particulier mis en évidence le rôle majeur des interactions électrostatiques dans l’immobilisation orientée des enzymes. Nous proposons que la connaissance de la charge de surface dans l’environnement du cofacteur de surface premier ou dernier relais des électrons, ainsi que de la valeur et de la direction du moment dipolaire induit par l’anisotropie des charges, sont les facteurs clés qui contrôlent le transfert d’électrons interfacial.
Dans le cas particulier des CueOs, la fonctionnalisation chimique des électrodes nous a permis de mettre en évidence le rôle d’un domaine riche en méthionines couvrant le Cu T1. Ce domaine modifie le chemin de TE comparativement aux autres MCOs, mais autorise une activité de détoxification via l’oxydation de Cu+ liés.
Electrode Nanostructuration
 🇬🇧 Electrode nanostructuration consists in changing electrode morphology using elements with size in nanometer range (typically less than 100 nm). This may include conductive nanoparticles, nanotubes, quantum dots or 2D-materials as graphene. These nanomaterials can display electrocatalytic properties on their own. However, the main advantage of nanostructuration for bioelectrochemistry is significant increase of electrode surface area compared with the geometric one. This allows more biocatalyst molecules to be immobilized on the electrode surface that may increase the resulting current density by several orders of magnitude.
🇬🇧 Electrode nanostructuration consists in changing electrode morphology using elements with size in nanometer range (typically less than 100 nm). This may include conductive nanoparticles, nanotubes, quantum dots or 2D-materials as graphene. These nanomaterials can display electrocatalytic properties on their own. However, the main advantage of nanostructuration for bioelectrochemistry is significant increase of electrode surface area compared with the geometric one. This allows more biocatalyst molecules to be immobilized on the electrode surface that may increase the resulting current density by several orders of magnitude.
Besides surface area enhancement, careful choice of the type, size and surface chemistry of the nanomaterials can lead to the increased rate of electron transfer between the redox enzyme and the electrode. We usually use different types of carbon nanotubes (CNT) and nanofibers to nanostructurate our electrodes. Once deposited, they provide a suitable porous conductive network for redox enzyme immobilization and carbon surface chemistry can be varied to increase the probability of favorable protein orientation. We also synthesize porous transparent electrodes based on transparent conducting oxides (indium & antimony tin oxide). As the synthesis involves sol-gel formation around latex beads used as pore templates, the pore size can be finely tuned by choosing the adequate bead diameter.
However, mesoporous materials often have large tortuosity that slows down the diffusion of soluble components inside the network. Together with high concentration of immobilized enzymes, this fact rapidly creates the deprivation in enzyme substrate in the deeper layers of the porous network during the bioelectrocatalysis. Therefore, we often combine nanomaterials with macroporous materials, such as carbon felt, in order to maintain the diffusional flux of substrates towards enzymes. We also use methods of numerical simulation to model an enzymatic reaction and diffusion in the porous bioelectrodes and to optimise their design.
🇫🇷 La nanostucturation d’une électrode consiste à en modifier la morphologie via des éléments de taille nanométrique (typiquement moins de 100 nm). Parmi ces éléments, on citera des nanoparticules (carbone, métal,…) conductrices, des nanotubes, nanofibres de carbone, des « quantum dots » ou des matériaux 2D comme le graphène. Ces nanomatériaux peuvent posséder des propriétés catalytiques intrinsèques. Cependant, l’avantage majeur de la nanostructuration est l’augmentation significative de la surface disponible pour l’électrocatalyse. L’augmentation consécutive du nombre de molécules enzymatiques à l’interface permet des accroissements des courants de catalyse de plusieurs ordres de grandeur.
Au-delà de l’augmentation de la surface, le choix du type de matériaux, de sa taille et de sa chimie de surface peut permettre une augmentation du transfert d’électrons interfacial. Au sein de l’équipe, nous utilisons principalement des nanoparticules d’or, et des nanotubes et nanofibres de carbone pour nanostructurer les électrodes. Les films ainsi formés fournissent une matrice dont la porosité est favorable à l’immobilisation des enzymes, et dont la chimie de surface peut être variée pour satisfaire aux exigences d’orientation de l’enzyme. Nous synthétisons également des électrodes transparentes poreuses à base d’oxydes transparents conducteurs (indium & antimony tin oxide). Comme la synthèse implique la formation de sol-gel autour de billes de latex utilisées comme modèles de pores, la taille des pores peut être finement ajustée en choisissant le diamètre de billes adéquat.
Néanmoins, la tortuosité de ces matériaux mésoporeux ralentit la diffusion des composants solubles en son sein. Ajouté à la forte concentration en enzymes, il s’en suit un appauvrissement rapide des substrats au cours de la catalyse. Il est donc nécessaire de combiner les nanomateriaux avec des matériaux macroporeux, comme des feutres de carbone, pour maintenir un flux de substrat suffisant. Pour optimiser la géométrie des électrodes, nous avons utilisé des méthodes de simulation numérique modélisant la réaction enzymatique et les processus de diffusion.
Development of Coupled Methods
🇬🇧 Electrochemical tools provide relevant information on the efficiency of the enzyme immobilization which is reflected both by the magnitude of the catalytic current and the shape of the cyclic voltammetry curves. Modelling of the latter allows calculating a parameter which is indicative of the distribution of orientation of the enzyme. However, any change of the electrochemical signal cannot be attributed to only one factor among release of the enzyme, modification in enzyme orientation or even enzyme denaturation. To get more insight in enzyme immobilization and to be able in fine to find ways for bioelectrode efficiency and stability, we develop coupled methods with electrochemistry.

SPR and QCM coupled to electrochemistry allow to determine the kinetics of enzyme adsorption while establishing the relationship between electroactivity and enzyme loading. Any change in enzyme amount on the electrode surface can be detected consecutively to modification of local environment. This especially allowed us to demonstrate that decrease with time in O2 catalytic reduction currents by BOD was due to other processes than desorption. This also allowed us to prove different enzyme orientation according to the charge of the electrochemical interface.
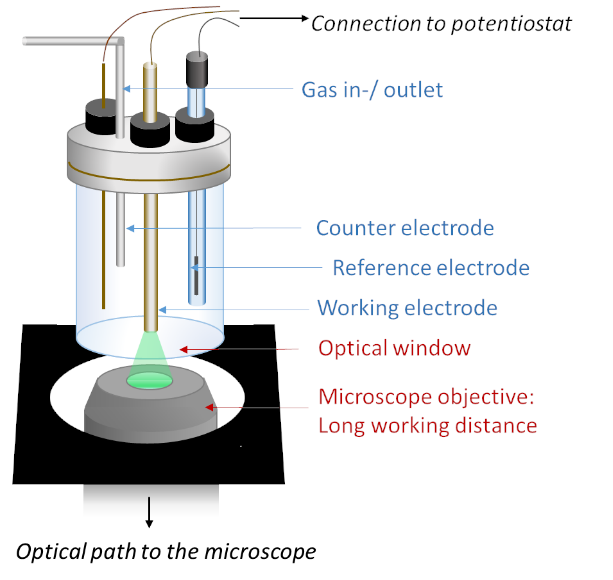 In situ coupling of e-fluorescence microscopy enables us to collect global electrochemical information about enzymatic processes as well as the corresponding local microscopic data at the electrode surface/volume simultaneously. This allows for the study of enzyme repartition and the catalytic heterogeneities at the electrode. Enzyme reactivity at the surface of the electrode can be characterized via e-fluorescence microscopy, using a fluorophore whose fluorescence is modulated by the enzymatic reaction.
In situ coupling of e-fluorescence microscopy enables us to collect global electrochemical information about enzymatic processes as well as the corresponding local microscopic data at the electrode surface/volume simultaneously. This allows for the study of enzyme repartition and the catalytic heterogeneities at the electrode. Enzyme reactivity at the surface of the electrode can be characterized via e-fluorescence microscopy, using a fluorophore whose fluorescence is modulated by the enzymatic reaction.
🇫🇷 L’analyse des réponses électrochimiques, en terme de magnitude et stabilité des courants, potentiel de la catalyse, ou encore forme du signal, fournissent des données essentielles quant à l’efficacité de l’immobilisation des enzymes à la surface des électrodes. La modélisation permet en outre de remonter au facteur de distribution d’orientation des enzymes à la surface. Cependant, une modification du signal électrochimique ne peut être attribuée à un seul des facteurs parmi le décrochage des enzymes, la modification de leur orientation, le changement de conformation voire la dénaturation des enzymes. Cette connaissance fine des modifications de la biointerface est pourtant un prérequis pour améliorer l’efficacité et/ou la stabilité des bioélectrodes. Dans cette optique, nous développons au laboratoire des méthodes de microscopie et de spectroscopie de surface couplée à l’électrochimie.
La résonnance plasmonique de surface ainsi que la microbalance à quartz couplées à l’électrochimie permet à la fois de déterminer la cinétique d’adsorption de l’enzyme à la surface de l’électrode, et de déterminer la relation entre quantité d’enzyme immobilisée et activité enzymatique. Tout changement dans la quantité d’enzyme immobilisé suite à un changement d’environnement local (temps, température, pH, force ionique, potentiel, etc…) peut être détecté à l’échelle de la monocouche. Ce couplage in situ nous a en particulier permis de montrer que la diminution du courant de catalyse de réduction de O2 dans le temps n’était pas liée à une perte progressive d’enzyme par relargage. Cette étude nous a permis de prouver une orientation de l’enzyme spécifique en fonction de la charge de l’interface électrochimique.
Le couplage in situ de la microscopie de fluorescence confocale et de l’électrochimie nous permet de caractériser les processus enzymatiques en enregistrant simultanément des informations électrochimiques à l’échelle globale de l’électrode, et les données microscopiques locales correspondantes. Ceci permet d’étudier la répartition de l’enzyme à la surface (ou dans le volume) de l’électrode; ou la distribution des hétérogénéités de la catalyse, et donc de caractériser l’activité enzymatique locale.
Enzymatic Fuel Cells
🇬🇧 Enzymatic fuel cells are a class of low temperature fuel cells in which the classical platinum-based catalysts are replaced by efficient and specific enzymes. The main advantage is the large biodisponibility of enzymes, the large panel of properties they can present depending on the organisms they are extracted from (high temperature, low pH, high salinity…) and the affinity for their substrate.
Most of the enzymatic fuel cells reported in the literature were based on glucose oxidation by the enzyme glucose oxidase in view of powering of implantable devices. The discovery of O2-tolerant hydrogenases, including in our laboratory, allowed to envision the development of H2/O2 enzymatic fuel cells. The advanced knowledge gained in our group on the functionalization of porous carbon electrodes for enhanced direct catalysis both for hydrogenases and bilirubin oxidases has permitted to design a fuel cell, operating with no platinum, over a large range of temperatures, at mild pH, and able to power wirelessly a sensor. Further, we were able to demonstrate that current as high as 1 A/mg enzyme can be reached. The modelling of the catalysis allowed to put forward the diffusional limitations appearing at such high current densities. Therefore, we focus now on the improving of bioelectrodes design by developing gas-diffusion enzymatic electrodes and using numerical modelling approach.

Beyond fuel cells we use enzymes with suitable activity and selectivity to develop other electrochemical enzymatic devices, such as biosensors and bioreactors.
🇫🇷 Les piles à combustible enzymatiques (BioPAC) constituent une classe de pila à combustible basse température pour lesquelles les catalyseurs à base de métaux nobles (Pt en particulier) sont remplacés par des enzymes hautement efficaces et spécifiques. Les principaux avantages de ces bioprocédés vont de la biodisponibilité des enzymes, à leur forte affinité pour les substrats en passant par le large panel de propriétés en fonction de l’organisme d’origine (haute T°, bas pH, forte salinité par exemple).
La majeure partie des piles à combustible enzymatique reportée dans la littérature utilise l’oxydation du glucose et sont développées pour des applications implantables. La découverte d’hydrogénases tolérantes à O2 et au CO, en particulier dans notre laboratoire, a initié le développement d’une nouvelle classe de BioPAC basé sur l’hydrogène comme fuel. Les connaissances acquises dans notre groupe autour de la fonctionnalisation appropriée des matériaux d’électrode pour la bioélectrocatalyse, ont permis de développer une BioPAC sans métaux nobles, fonctionnant sur une gamme de température allant de 10 à 70°C, à des pH modérés. Un démonstrateur a été construit qui a permis de valider l’utilisation de cette BioPAC pour alimenter un capteur et son électronique. La modélisation de la catalyse a permis de déterminer l’épaisseur optimale de carbone poreux. Grâce à la quantification des enzymes électrochimiquement actives tant à l’anode qu’à la cathode, un courant de l’ordre de 1 A/mg d’enzyme a pu être calculé ! La modélisation de la catalyse a permis de mettre en avant les limitations diffusionnelles apparaissant à des densités de courant aussi élevées. Par conséquent, nous nous concentrons maintenant sur l’amélioration de la conception des bioélectrodes en développant des électrodes enzymatiques à diffusion de gaz et en utilisant une approche de modélisation numérique.
Au-delà des piles à combustible, nous utilisons des enzymes avec une activité et une sélectivité appropriées pour développer d’autres dispositifs enzymatiques électrochimiques, tels que des biocapteurs et des bioréacteurs.
