Métabolismes énergétiques microbiens et enzymes redox
Microbial energy metabolisms and redox enzymesRecherche (Fr)
Notre groupe étudie diverses enzymes redox bactériennes, depuis leur mécanisme moléculaire jusqu’à leur rôle physiologique. L’objectif est de mieux comprendre d’une part le fonctionnement de ces enzymes et d’autre part le métabolisme énergétique des micro-organismes.
Ces enzymes sont pour la plupart impliquées dans les métabolismes énergétiques de l’hydrogène, du soufre ou encore de l’oxygène. Plus récemment, l’équipe s’est intéressée à des enzymes et voies métaboliques utilisant ou libérant du CO2. Le but, en plus de leur caractérisation moléculaire (par diverses approches biochimiques ou biophysiques : purification de protéines ou complexes solubles ou membranaires, activités enzymatiques, gels bleu natifs, spectroscopies, électrochimie, …), est pour certaines d’entre elles, de déterminer leur fonction dans le métabolisme énergétique cellulaire. Le rôle de ces protéines dans la cellule est abordé en combinant biologie moléculaire, microbiologie, génétique et biochimie telles que des croissances bactériennes dans différentes conditions, des délétions de gènes ou encore l’étude de modifications du métabolome, du transcriptome et du protéome. Ces approches nous permettent de reconstituer les voies métaboliques énergétiques que nous étudions.
Des bactéries diverses d’un point de vue physiologique et phylogénétique sont cultivées : Solidesulfovibrio fructosivorans (anaérobie sulfato-réductrice) et Aquifex aeolicus (hyperthermophile, microaérophile, hydrogène et soufre-oxydante). Des enzymes issues de bactéries environnementales ou pathogènes sont également étudiées :Escherichia coli, Helicobacter pylori et Dehalococcoides mccartyi.
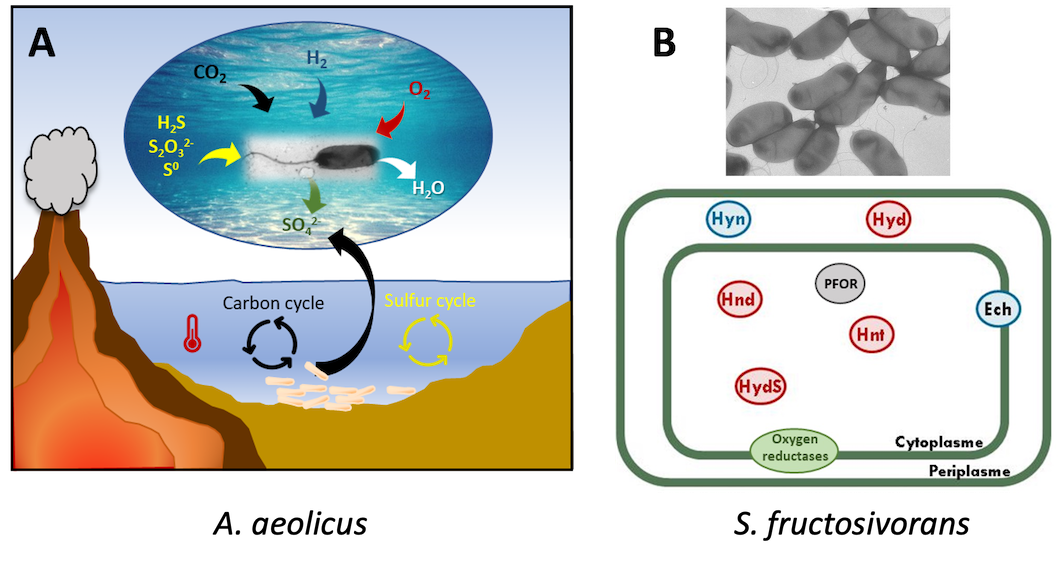
Nos recherches portent principalement sur les hydrogénases qui sont des enzymes qui catalysent de façon réversible, l’oxydation de l’hydrogène moléculaire en protons. Nos travaux ont pour but d’étudier le rôle des hydrogénases dans le métabolisme énergétique des cellules ainsi que les mécanismes réactionnels de ces enzymes. Nous développons ainsi une approche pluridisciplinaire intégrée du métabolisme de l’hydrogène, en étroite collaboration avec les équipes de chimistes et de physiciens de l’unité, depuis l’enzyme et l’acte catalytique jusqu’à ses fonctions cellulaires et son rôle dans les mécanismes générateurs d’énergie. Nos travaux s’insèrent donc dans l’axe thématique « hydrogène et métabolismes associés » du laboratoire. Nous étudions plusieurs modèles biologiques parmi lesquels la bactérie sulfato-réductrice Solidesulfovibrio fructosivorans, particulièrement intéressante puisqu’elle possède un système complexe de six hydrogénases différentes: 4 hydrogénases à [FeFe] et 2 hydrogénases à [NiFe]. Pourquoi une telle diversité des hydrogénases dans un même organisme? Quel est le rôle de ces enzymes ?
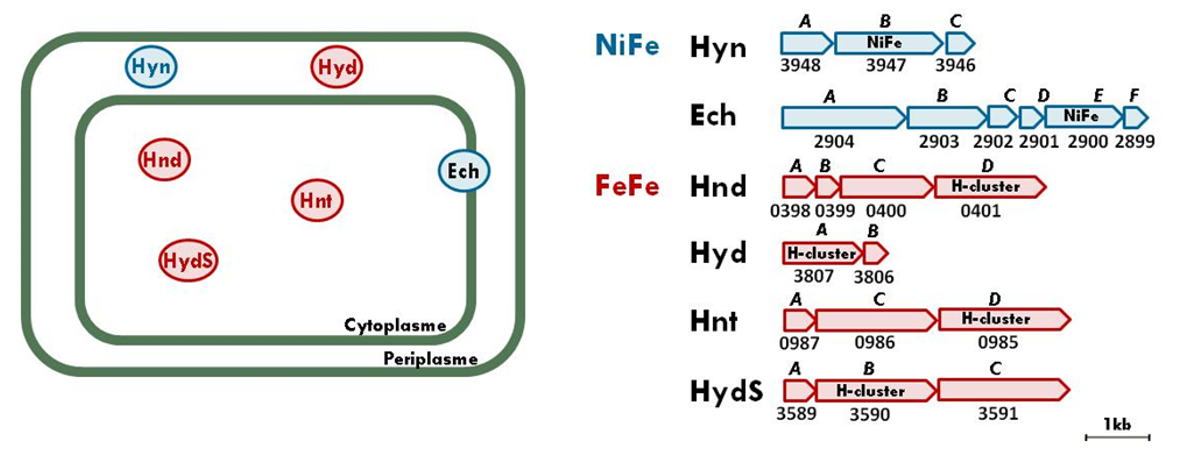
Ces dernières années, nos recherches se sont focalisées sur l’étude d’une hydrogénase à [FeFe] de cet organisme, Hnd, qui réalise la bifurcation des électrons. Les enzymes qui bifurquent les électrons réalisent le couplage énergétique d’une réaction rédox exergonique avec une réaction rédox endergonique.
Il a en effet été montré que ces hydrogénases couplent la réduction des protons à l’oxydation endergonique du NADH et à l’oxydation exergonique concomittante d’une ferredoxine réduite (et/ou la réaction inverse). Nous étudions cette enzyme depuis son fonctionnement moléculaire jusqu’à son rôle physiologique dans la bactérie. En ce qui concerne son implication dans la physiologie bactérienne, nous avons montré qu’Hnd est impliquée dans le métabolisme de l’éthanol. C’est une hydrogénase réversible qui fonctionne en consommation d’H2 par un mécanisme de bifurcation d’électrons pendant la fermentation du pyruvate et en production d’H2 par un mécanisme de confurcation d’électrons lorsque la bactérie utilise l’éthanol comme donneur d’électrons, condition dans laquelle Hnd est essentielle à la croissance bactérienne.
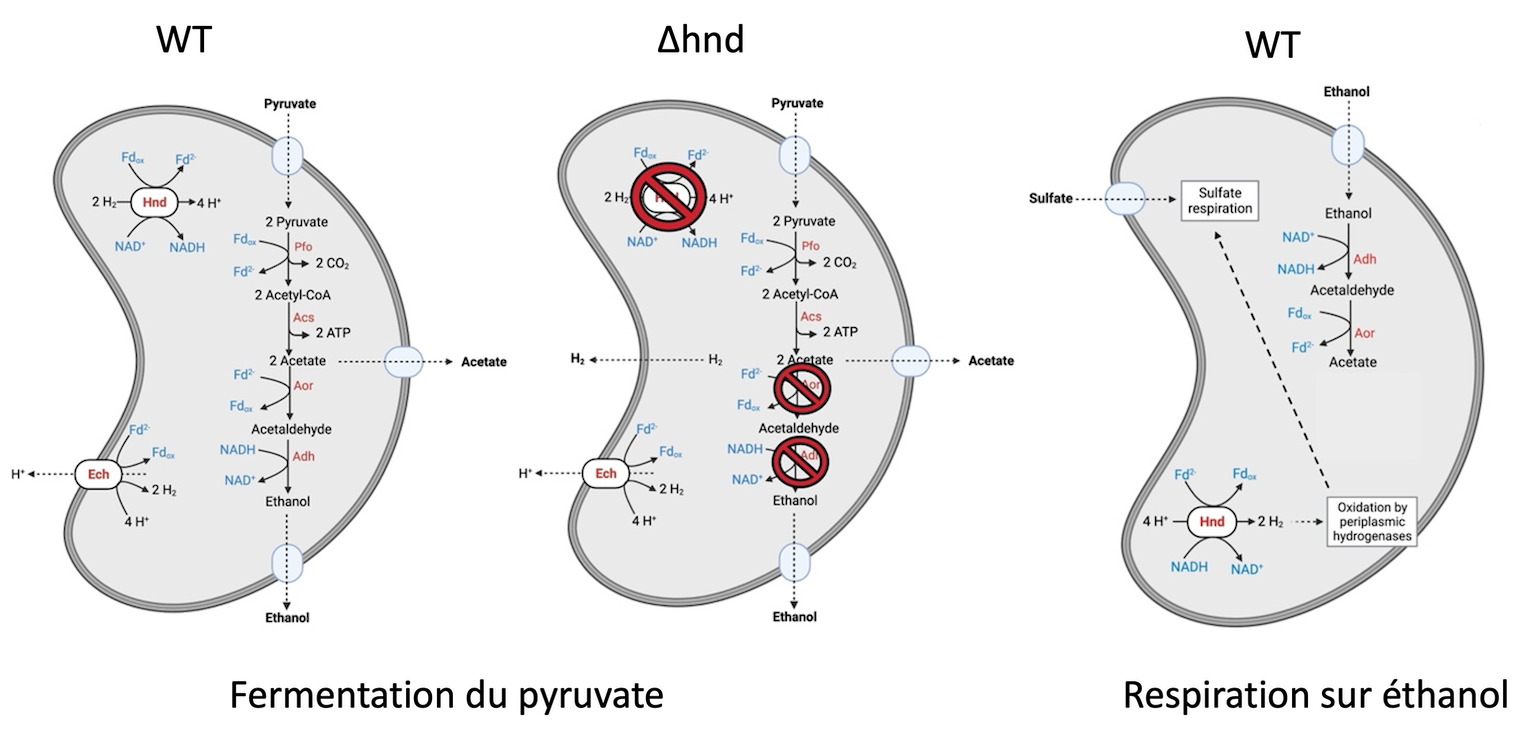
Voies de fermentation du pyruvate et d’oxydation de l’éthanol chez la souche sauvage (WT) et la souche mutante (∆hnd) de S. fructosivorans (Payne et al. 2022; Kpebe et al. 2023)
Nos recherches ont également pour objectifs de lever les verrous scientifiques à l’utilisation des hydrogénases dans des procédés biotechnologiques et notamment de comprendre les bases moléculaires de l’inactivation des hydrogénases par l’O2 qui est une des limitations principales actuelles. Ces recherches se font en collaboration avec l’équipe BIP6. En effet, le dihydrogène est considéré comme un carburant « propre » du futur, en alternative aux carburants fossiles à condition qu’il ne soit plus produit à base d’énergie fossile. Dans ce contexte, la conversion de l’énergie solaire en H2 constitue une stratégie attrayante pour la bioproduction de ce combustible.
L’ANR soutient nos recherches sur les hydrogénases : Engineering-H2 Cyano, 2009-2013 ; Algo-H2, 2011-2015 ; Cyanhy, 2013-2017 ; Heros, 2014-2019 ; Otolhyd, 2019-2023 ; Hydre, 2024-2028.
Au sein de l’équipe nous menons également des recherches concernant les oxydases terminales et la respiration aérobie bactérienne. Actuellement, nous nous intéressons en particulier à l’oxydase de type bd (de Solidesulfovibrio fructosivorans et d’Escherichia coli). Par des approches de biochimie, biophysique et physico-chimie, en collaboration avec l’équipe « Biophysique des métalloprotéines et des systèmes dynamiques » du laboratoire, nous réalisons une étude moléculaire et fonctionnelle de cette enzyme.
L’équipe cherche également à comprendre le rôle des différentes oxydases terminales (oxydases de type bd ou à hèmes-cuivre) chez la bactérie hyperthermophile Aquifex aeolicus, se développant de façon optimale en présence de faibles concentrations de O2.
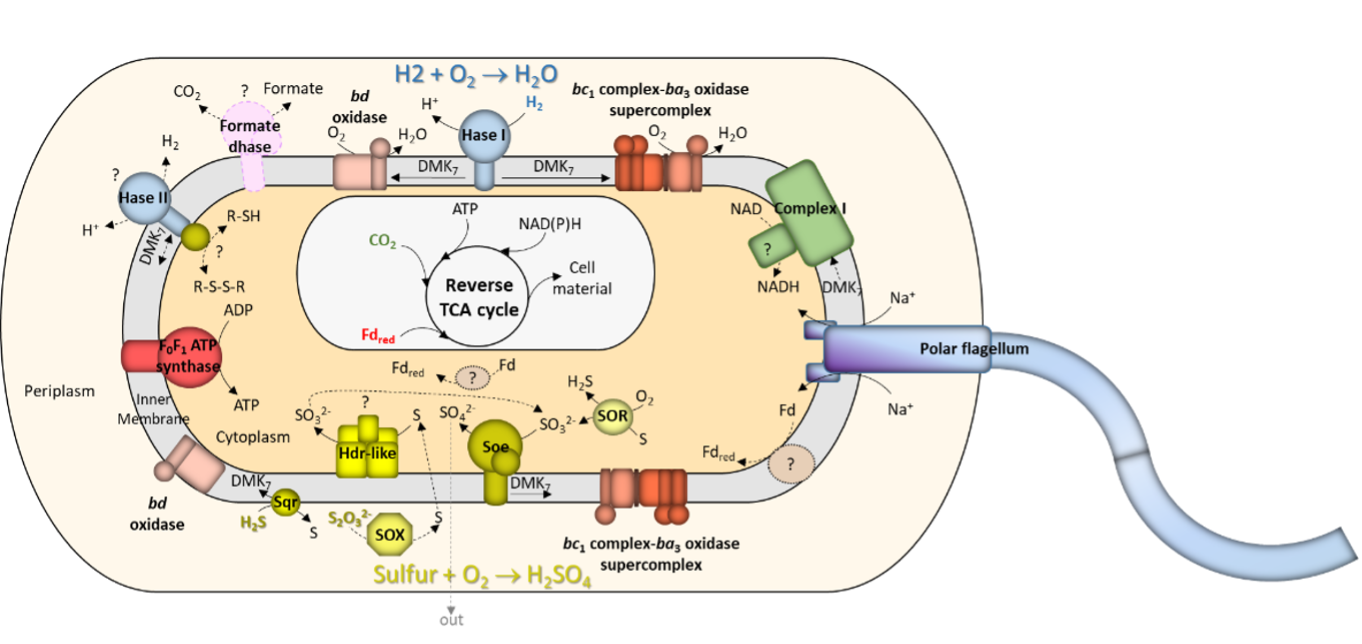 Energy conservation and carbon assimilation in Aquifex aeolicus (Guiral & Giudici-Orticoni, 2021)
Energy conservation and carbon assimilation in Aquifex aeolicus (Guiral & Giudici-Orticoni, 2021)
Le métabolisme oxydatif procaryote du soufre est complexe et pas entièrement compris. Nous essayons de mettre en évidence et caractériser des enzymes impliquées dans ces voies d’oxydation (Sulfite déshydrogénase SoeABC, complexe hétérodisulfure réductase Hdr ou soufre transférases par exemple) chez la bactérie hyperthermophile Aquifex aeolicus, en utilisant principalement des approches de biochimie et protéomique.
Cette caractérisation des enzymes du soufre nous a conduit à nous intéresser récemment, chez A. aeolicus, à la conversion de l’arsenic (formes réduite et oxydée) et du thioarsenic (en collaboration avec l’équipe du BIP « Evolution de la bioénergétique ») qui pourrait se faire chez certaines bactéries par des enzymes connues pour utiliser des composés soufrés (comme le système Sox d’oxydation du thiosulfate S2O32-). Cet aspect du travail fait intervenir de la biologie moléculaire, de la microbiologie et de la biochimie.
- Diversité des Pyruvate ferrédoxine oxydoréductases (PFOR)
La Pyruvate ferrédoxine oxydoréductase (PFOR) est une métalloenzyme qui catalyse de manière réversible la réaction suivante :
CoA + pyruvate + Fdox ⇄ Acetyl−coA + CO2 + Fdred (Fd = ferredoxin)
C’est une enzyme essentielle du métabolisme central de diverses bactéries et parasites anaérobies pathogènes et n’est pas présente chez les mammifères. Il est donc très intéressant de trouver des inhibiteurs spécifiques du site actif des PFOR. Ces enzymes sont assez peu étudiées, il est donc aussi intéressant de mieux comprendre leur réactivité, leur diversité et les relations structure-fonction dans ces enzymes.
Nous produisons et caractérisons au niveau moléculaire de la PFOR de différents organismes, afin de déterminer leurs propriétés catalytiques et leur sensibilité aux inhibiteurs, y compris le dioxygène. La synthèse de nouveaux potentiels inhibiteurs se fait en collaboration avec Michel Maffei (ISm2, Marseille).
- Fixation du CO2 chez A. aeolicus
Nous avons entamé l’étude de certains aspects de la fixation du CO2 chez A. aeolicus qui est autotrophe obligatoire. Cette bactérie assimile le CO2 par l’intermédiaire du cycle inverse des acides tricarboxyliques (rTCA) qui fait intervenir la PFOR et l’OGOR, deux enzymes pentamériques qui utilisent une ferrédoxine réduite pour fonctionner, que nous avons caractérisées. Ce travail a pour objectif d’explorer la capacité de ce microorganisme à coupler la fixation du CO2 via le rTCA à l’oxydation de l’hydrogène ou de composés soufrés et de comprendre comment les ferrédoxines de bas potentiels redox impliquées dans la fixation du carbone sont réduites chez A. aeolicus.
